Guarda la mia video intervista a Radio Roma Capitale – Live Social, potrai scoprire di più su di me e sui miei prodotti.


Guarda la mia video intervista a Radio Roma Capitale – Live Social, potrai scoprire di più su di me e sui miei prodotti.
Wound Care e gestione delle Skin Tears. Il ruolo dell’Infermiere specialista in lesioni cutanee.
By Dott.ssa Apollonia De Vita – Dott.ssa Monica Cardellicchio
 Il ruolo fondamentale dell’Infermiere specialista in Wound Care e la gestione delle Skin Tears nei pazienti fragili e meno fragili. Ecco come gestire correttamente questo tipo di lesioni cutanee.
Il ruolo fondamentale dell’Infermiere specialista in Wound Care e la gestione delle Skin Tears nei pazienti fragili e meno fragili. Ecco come gestire correttamente questo tipo di lesioni cutanee.
“Una skin tear è il risultato di una forza di taglio, sfregamento o trauma contusivo che provoca la separazione degli strati della pelle. Le lesioni sono a spessore parziale o totale a seconda del danno tissutale”. Una skin tear può essere a spessore parziale (separazione dell’epidermide dal derma) o a spessore intero (separazione dell’epidermide e del derma dalle strutture sottostanti) Le Blanc e Baranoski,2011).
L’etiologia suggerisce che i cambiamenti fisiologici della cute legati all’età avanzata assieme a comorbilità, siano tra i principali fattori di rischio per la loro insorgenza.
Anche nei neonati i principali fattori di rischio per le Skin tears sono legati principalmente al fissaggio di dispositivi salvavita sulla pelle dei bambini prematuri, che è sottile ed estremamente fragile. È fondamentale utilizzare prodotti quanto meno adesivi possibile, poiché la ridotta coesione tra il derma e l’epidermide può essere meno forte di quella che si crea tra l’epidermide e un prodotto adesivo , e di conseguenza la rimozione dell’adesivo può provocare uno strappo dell’epidermide, causando così una lacerazione cutanea.
L’80% delle skin tears si verifica a livello degli arti superiori, sono comunque a rischio tutte le zone cutanee soggette alle forze sopraelencate (es. sono molto frequenti anche negli arti inferiori o in zone di frizione e sfregamento come il sacro), i fattori di rischio sono molteplici e comprendono:
Le Skin Tears interessano tutto il mondo e solo nel 1990 sono state ben definite. Anche l’AISLEC nel 2014 ha sviluppato un progetto di studio in Italia con raccolta dati.
A Maggio a San Marino l’AISLEC ha organizzato un convegno leggendo i risultati di tale studio a cui abbiamo partecipato.
Sono a disposizione tre diverse scale per la classificazione delle skin tears:
La Scala di Pain Martin, prende in considerazione l’entità della perdita tissutale dopo che si è riposizionato il flap cutaneo e non comprende lo stato vitale del lembo.
Si compone di cinque categorie:
La Scala STAR, acronimo di skin tear classification system è una scala australiana che valuta la perdita tissutale e la vitalità del flap cutaneo. Si divide in 5 categorie: temp mail
La Scala ISTAP (International Skin Tears Advisory Panel), comprende tre livelli:
Quando il lembo cutaneo è presente si consiglia sempre di utilizzare in prima battuta il metodo conservativo, se la lesione sanguina si può esercitare pressione con una garza bagnata o utilizzare una medicazione a base di alginato per arrestare il sanguinamento.
La lesione va pulita anche sotto il lembo con fisiologica o acqua, non è raccomandato l’utilizzo di antisettici poiché citotossici.
Quale best practice?
La best practice dice di riposizionare il lembo srotolandolo delicatamente senza trazionarlo , è possibile avvalersi di utensili atraumatici come un cotton fioc bagnato per aiutarsi nella manovra, il lembo deve essere rimosso solo se non è più vitale. Ad ogni cambio di medicazione, la stessa dovrebbe essere rimossa delicatamente nella direzione indicata dalla freccia. Se non viene rimossa facilmente, è consigliabile utilizzare soluzioni assorbenti saline o rimozione di adesivi a base di silicone (Mudge e Orsted, 2010). Il lembo della ferita può essere molto friabile quindi occorre prestare attenzione per evitare che venga disturbato.
Se possibile, la medicazione deve essere lasciata in sede per diversi giorni per evitare di disturbare il lembo. Non è opportuno utilizzare le pinze chirurgiche perché causano traumatismo o addirittura la rottura del lembo. Se risulta difficile riposizionare il lembo, l’infermiere deve applicare delle garze sterili inumidite sul lembo per 5-10 minuti, per reidratarlo e poi procedere con il riposizionamento (LeBlanc et al., 2011; LeBlanc et al., 2017).
O’Regan (2002) ha esaminato la letteratura sulle Skin Tears e ha concluso che le ferite devono essere trattate in modo sistematico, compresa la pulizia con soluzione fisiologica, controllare il sanguinamento, la rimozione di coaguli e l’utilizzo di una medicazione adeguata secondo le caratteristiche del letto di lesione.
Le medicazioni devono essere tenute in posizione con prodotti stocking-like (per esempio un bendaggio tubolare). Occorre effettuare, inoltre, la valutazione del dolore (LeBlanc e Baranoski, 2011; Stephen Hayes e Carville, 2011).
La ferita andrebbe osservata per identificare segni di infezione ed eventuali variazioni del colore del tessuto del lembo, che potrebbero indicare che sta diventando non vitale ( Stephen Hayes e Carville, 2011).
E’ possibile ridurre l’incidenza delle Skin Tears?
La letteratura suggerisce che sia possibile ridurre l’incidenza delle skin tears di almeno il 50% grazie all’implementazione di protocolli specifici e alla formazione del personale, vero nodo cruciale della prevenzione delle skin tears stesse.
Nella cura delle Skin Tears , è fondamentale valutare, classificare e trattare opportunamente la lesione, così da evitare complicazioni e selezionare la medicazione più adeguata, in grado di creare un ambiente terapeutico isolato che favorisca una guarigione il più rapida possibile. È essenziale scegliere una medicazione che crei un ambiente umido per la guarigione della ferita e vada a sigillare i margini della lesione, in modo da evitare fuoriuscite e ridurre al minimo la macerazione cutanea. Al contempo, non bisogna mai dimenticare di rispettare la fragilità della cute circostante.
Le fasi di trattamento di una skin tear, riconosciute in letteratura sono:
La scelta della medicazione dipende da:
Le medicazioni raccomandate, invece, sono :
Come prevenire le Skin Tears?
Per prevenire le Skin Tears si dovrebbe identificare precocemente i soggetti a rischio ed identificare sul paziente i fattori di rischio intrinseci ed estrinseci. Una volta identificati i rischi si attuano interventi di prevenzione (LeBlanc, 2011). Nella cura della cute bisogna :
Nell’ambulatorio infermieristico di Wound Care del Distretto Socio Sanitario Unico di via Ancona di Taranto vengono gestiti pazienti con Skin Tears.
Le Skin Tears vengono trattate in questo modo:
Secondo l’art. 10 del codice deontologico 2019, l’Infermiere fonda il proprio operato su conoscenze validate dalla comunità scientifica e aggiorna le competenze attraverso lo studio e la ricerca, il pensiero critico, la riflessione fondata sull’esperienza e le buone pratiche, al fine di garantire la qualità e la sicurezza delle attività. Pianifica, svolge e partecipa ad attività di formazione e adempie agli obblighi derivanti dal programma di Educazione Continua in Medicina.
L’infermiere Wound Care, infatti, è in grado di:
L’ infermiere Wound Care pertanto, è un professionista che può esercitare una competenza specifica nell’area assistenziale clinica, nell’ambito della prevenzione e cura delle lesioni cutanee e dell’uso delle medicazioni cosiddette “avanzate”, che può operare nei settori assistenziali, organizzativi e gestionali ove tali competenze sono ormai necessarie a realizzare un’assistenza sanitaria orientata al cliente, e impegnata nello sviluppo delle strutture e delle tecnologie di progetti formativi inerenti il wound care.
Bibliografia.
La mielolesione è una condizione fisica che comporta disabilità grave e permanente nelle persone che ne sono affette, nei casi più gravi può portare alla morte. Purtroppo si è assistito negli ultimi anni ad un aumento dell’incidenza delle lesioni midollari a causa di sempre più frequenti incidenti stradali, mentre i traumi sul lavoro, le cadute nello sport e gli incidenti domestici rappresentano una percentuale inferiore dei casi; le fasce d’età riguardo una popolazione compresa in particolare tra i 15 e i 70 anni, prevalentemente maschile, maggiori sono i casi di paraplegia rispetto a quelli di tetraplegia.
Il danno osteoarticolare più frequente associato alla lesione midollare è la frattura vertebrale, seguita dalle fratture / lussazioni e dalle lussazioni semplici, mentre in alcuni casi non è evidente alcun danno a carico della colonna. L’intervento chirurgico dopo una lesione al midollo viene eseguito con finalità di decompressione del midollo stesso e stabilizzazione della colonna. Le lesioni midollari non traumatiche vedono come cause più ricorrenti le neoplasie, i problemi vascolari, degenerativi e infiammatori/ infettivi.
Le piaghe da decubito sono spesso da ricollegarsi a problemi di natura vascolare, alle lesioni complete e al ricovero precedente nei reparti di chirurgia. Nella fase acuta, la complicanza più frequente è proprio la piaga da decubito, ancor più di quelle respiratorie ed urinarie, delle trombosi profonde, dell’embolia polmonare e delle para-osteo-artropatie, le cosiddette POA.
Le Unità Spinali (US) rappresentano strutture dedicate esclusivamente alla cura delle mielolesioni, appena dopo la fase acuta: il paziente una volta dimesso dalla US presenta minori complicanze e rientra, nella maggior parte dei casi, al proprio domicilio. Pertanto, pur rimanendo critico il problema della fase acuta, che il paziente passerà nei reparti di neurochirurgia, esistono in Italia centri come le US, che possiedono i requisiti per una gestione globale e per il trattamento delle complicanze nella mielolesione migliorando in tal modo l’outcome del paziente.
Un inadeguato nursing riabilitativo (negligenza e scarsa attenzione degli operatori) sarà causa dell’insorgenza di lesioni da decubito.
Le lesioni da decubito si manifestano a carico dei tessuti molli in quelle zone del corpo dove la parte ossea è più prominente a causa di una prolungata e/o eccessiva pressione: questo fenomeno provoca un’alterazione della vascolarizzazione con un’iniziale lesione dei tessuti che può degenerare in necrosi degli stessi. L’immobilità del paziente, la scarsa igiene, gli spostamenti scorretti, gli squilibri del metabolismo e la riduzione del trofismo muscolare sono tutti aspetti che facilitano l’insorgenza delle piaghe da decubito. Le zone del corpo maggiormente interessate sono: il padiglione auricolare, la nuca, i gomiti, le scapole, la zona sacrale, i trocanteri, i malleoli e i talloni.
Le lesioni da decubito vengono classificate a seconda della gravita in I,II,III e IV stadio. L’aspetto della prevenzione appare quindi basilare: l’uso del materasso antidecubito è indispensabile e oggigiorno, è disponibile una vasta gamma di essi: ad aria, in fibra cava, in lattine etc.. Quelli ad aria sono più utilizzati per i loro ottimi risultati.
Altrettanto importante per la prevenzione delle lesioni da pressione è l’uso di cuscini antidecubito sia a letto che in carrozzina. Anche di questi ne esistono diversi tipi: ad aria, in schiuma, ad acqua, in gel, in microparticelle di polistirolo, in fibra cava siliconata e multistrato.
Il processo di nursing della persona mielolesa in fase acuta e sub-acuta prevede quindi obbligatoriamente l’utilizzo di questi ausili, adeguatamente adoperati su indicazione di figure specifiche quali il fisioterapista ed il terapista occupazionale, al fine di prevenire l’insorgenza delle piaghe da decubito.
FONTE: www.w-care.it
Dall'osservazione della pratica quotidiana si rileva una sensibile disomogeneità di intervento da parte degli operatori sanitari per quel che concerne la prevenzione e il trattamento delle LDP (lesione da pressione), che sfocia talvolta in risultati poco soddisfacenti. Tale difformità varia non solo da nosocomio a nosocomio, ma anche da RSA a Hospice e a Casa Protetta. Per ovviare a ciò si suggerisce sempre di agire basandosi su percorsi assistenziali comprovati e validati e, in particolare, di fare riferimento alle Linee Guida pubblicate sul sito PNLG (Piano Nazionale Line Guida) così come evidenziato dalla Leggi Gelli Bianco n. 24 dell'8/3/2017. L'articolo sintetizza l'applicazione di linee guida e scale di valutazione nella medicazione delle lesioni cutanee per evitare l'apporto di dolore inutile, suggerendo tecniche e procedure pratiche.
Quale ruolo delle superfici antidecubito nel wound care?
Quando si parla di attuare attività di prevenzione per evitare l’insorgenza delle lesioni da pressione, così come le linee guida internazionali impongono, molte volte non ci soffermiamo a definire le superfici antidecubito esistenti, le loro funzioni ed il loro corretto utilizzo nell’ambito assistenziale di riferimento.
In questo modo ci ritroviamo a dover rilevare spiacevoli sorprese che ci espongono al rischio di ricevere una denuncia. Nella pratica quotidiana a seconda della struttura in cui si lavora, a seconda della zona geografica e a seconda della formazione universitaria ricevuta notiamo un differente approccio in tema di prevenzione e trattamento delle Lesioni da parte degli Operatori Sanitari, che può sfociare in risultati poco soddisfacenti.
Per ovviare a ciò e per essere allineati alle Legge Gelli Bianco n. 24 dell’8/3/2017 si suggerisce sempre di agire basandosi su percorsi assistenziali comprovati e validati ed in particolare di far riferimento alle Linee guida pubblicate sul PNLG (Piano nazionale Linee Guida).
Uno degli indicatori di V.Q. americani (Verifica e Qualità) prevede che nei prossimi anni si realizzeranno le seguenti condizione:
• Il 2% della popolazione dei paesi industrializzati sarà affetto da L.D.P. a causa dell’aumento della sindrome ipocinetica.
• Gli ultrasessantenni affetti da L.D.P. avranno una mortalità per complicanze infettive collegate alle alle stesse del 38%.
In Svezia (1996) un infermiere domiciliare dedica al trattamento delle L.D.P. il 25% del suo tempo lavorativo. L’ 11% dei ricoverati è affetto da L.D.P. che sviluppa in ambiente domiciliare, con costo aggiuntivo per paziente è di circa 3,500€.
In Francia (1998) invece, si ha un costo di prevenzione che si aggira ai 200.000€ annuali (quasi uguale agli U.S.A.).
In Italia il fenomeno non è ben definito perché l’ultima indagine condotta a livello nazionale nell’ambito di un progetto europeo, risale al 2004 rilevando un tasso di prevalenza pari al 10,8% mentre nel 90,6% dei casi non erano state prese misure preventive.
La Lesione da Pressione è una lesione tessutale, con evoluzione necrotica, che interessa la cute, il derma e gli strati sottocutanei, fino ad interessare nei casi più gravi le fasce muscolari e le strutture ossee.
Essa è la conseguenza diretta di un’elevata e\o prolungata compressione a livello delle prominenze ossee a cui si associano le forze di taglio e di stiramento che causano uno stress meccanico ai tessuti, con conseguente strozzamento (e quindi chiusura) dei distretti venosi ed arteriosi.
Tutte le Linee Guida ed i documenti di posizionamento in tema di Lesioni riportano l’utilizzo di superfici specifiche per evitare l’insorgenza delle LDP.
Per superficie antidecubito intendiamo un dispositivo medico progettato per la redistribuzione delle pressioni in grado di gestire i carichi tissutali, gestire le forze di frizione e di scivolamento e capace di migliorare il microclima.
La sua funzione principale si esplica in “prevenzione” ma si è visto che l’utilizzo di tali sistemi, se di ultima generazione, migliorano i processi di guarigione di lesioni già esistenti favorendo la granulazione e svolgendo anche un’attività terapeutica sul dolore.
I presidi antidecubito presenti sul mercato sono numerosi e differenti per dimensioni, forme e materiali pertanto necessita fare una giusta informazione per individuare la superficie più idonea che possa migliorare l’appropriatezza prescrittiva nel rispetto delle necessità del paziente oltre al confort dell’operatore.
Le lesioni da pressione si sviluppano per una concomitanza di fattori estrinseci ed intrinseci. Lo strumento più utilizzato per la valutazione dei fattori di rischio di compromissione dell’integrità cutanea trova nella scala di Braden un buon alleato. Il modello concettuale posto da Braden nel 1987 pone l’accento sull’importanza di tenere sotto controllo l’aumento della pressione conseguente alla riduzione della mobilità e dell’attività, la diminuzione della tolleranza dei tessuti a causa delle forze di frizione di taglio, all’aumento dell’umidità oltre all’alterazione dello stato nutrizionale e dello stato di coscienza.
La pressione che si sviluppa in una data area è influenzata essenzialmente dalla superficie su cui ci si poggia. In particolare, per una data unità di superficie, maggiore è la superficie di appoggio e minore è la pressione che si sviluppa su quell’area e viceversa, minore è la superficie di appoggio e maggiore è la pressione che si sviluppa su quell’area. Per intenderci, un paziente in posizione supina ha una superficie di appoggio più estesa e redistribuisce tutto il suo volume a differenza di un paziente che si posiziona seduto e che avrà una base di appoggio diminuita oltre a far intervenire le forze di taglio e di frizione.
Le proprietà caratteristiche da prendere in considerazione per valutare le superfici antidecubito sono:
• Immersione o grado di affondamento che evidenzia la capacità di immergere la persona nella sua struttura permettendo alla pressione di redistribuirsi sulla superficie circostante piuttosto che concentrarsi a livello osseo
• Avvolgimento o capacità di conformarsi alla irregolarità del soggetto senza realizzare un incremento di pressioni a livello osseo
• Bottoming out o fenomeno di affondamento eccessivo che mette il paziente nelle condizioni di toccare il fondo del materasso.
Rispetto ai materassi tradizionali, le superfici antidecubito sono progettate appositamente per redistribuire le pressioni attraverso l’adattamento della superficie all’anatomia del corpo umano, in modo che la stessa sia la più ampia possibile. Tali condizioni vengono meno nel momento in cui non c’è proporzione tra il peso del paziente ed il volume occupato (pz. Amputato o pz. Con marcata obesità addominale e quando il peso del paziente eccede la portata terapeutica della superficie), anche quando il paziente assume la posizione semiseduta (questa evenienza non accade nelle superfici completamente automatiche) ed infine quando la superficie risulta essere sgonfia per errata regolazione. (Cella unica a salsicciotto).
Quindi è importante evidenziare i materiali con cui è fabbricato il dispositivo e le sue caratteristiche tecniche che ne sottolineano la capacità di assecondare le curvature fisiologiche del corpo che si stende sul supporto.
Fermo restando l’osservazione di tutti gli altri parametri essenziali per il contesto assistenziale il mondo dei Device ha immesso in commercio una serie di nuovi dispositivi antidecubito a bassa pressione completamente automatici in grado di indicare in tempo reale le pressioni di lavoro del materasso stesso. Tali superfici non sono rientrate nell’aggiornamento della Consensus sulle superfici antidecubito dell’AISLeC (2011) in quanto sono brevetti successivi al 2012. Inoltre gli studi reperiti per la revisione della consensus erano pochi ed ancora contrastanti tanto da avere una bassa forza di evidenza che implicava un protocollo di azione in cui era inserita la mobilizzazione manuale del paziente almeno ogni 4/6 ore.
Le superfici antidecubito si dividono in Superfici Statiche e Superfici Dinamiche. Le superfici Dinamiche a loro volta si distinguono in superfici a Bassa pressione (alternata o continua) e a Cessione d’aria (bassa cessione, alta cessione).
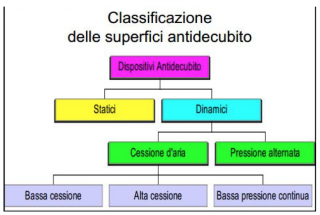
Tra le superfici statiche più conosciute troviamo i Materassi in poliuretano ed i materassi Termosensibili (registrati come dispositivi medici) anche denominati in viscoelastico per differenziarsi dai materassi standard. Sono dotati di cover traspirante, permeabili ai vapori e impermeabili all’acqua. Si tratta di superfici in grado di redistribuire le pressioni su una superficie più ampia in base alla densità del materiale utilizzato per la sua costruzione, all’effetto memoria, allo spessore e al grado di modellamento al corpo determinata dalla temperatura o dal carico dello stesso.
Una buona alternativa sono le superfici statiche ad aria statica. Prodotti molto semplici nell’uso che richiedono poca manutenzione. Affinchè si possa avere una buona riduzione della pressione, la pressione di gonfiaggio andrebbe controllata ogni giorno con apposito manometro in mmHg. Alcune superfici devono essere regolate anche in base al peso del paziente, mentre altre sono dotate di valvola precalibrata che riesce a dosare la corretta quantità di aria sufficiente a supportare la redistribuzione di un peso fino a 100 Kg. ed oltre.
Una riflessione che possiamo fare sulle superfici statiche è inerente all’inserimento nel nomenclatore di superfici in fibra cava siliconata. Secondo le Linee Guida della Regione Toscana: Ulcere da pressione: prevenzione e trattamento, che sono state recepite dal PNLG (Piano Nazionale Linee Guida) e quindi devono essere riferimento di condotta ai fini della Legge Gelli Bianco n. 24 dell’8/3/2017, di tali superfici si scrive: … “I materassi ad acqua e a fibre cave non possono essere raccomandati nella prevenzione delle ulcere da pressione (Groen 1999)…” (cito testualmente). Sorge spontaneo chiedersi come mai sono state inserite anche nel nuovo nomenclatore se è dimostrata la loro inefficacia nello scarico delle pressioni.
Le superfici dinamiche sono composte da due parti:
• Materasso
• Compressore
Ognuno con le proprie caratteristiche tecniche.
Il compressore insufla aria all’interno del materasso che può essere composto da un differente numero di celle a seconda della funzione dello stesso. Le celle riempite di aria si gonfiano e sgonfiano in maniera alternata (fluttuazione) secondo un ciclo temporale che rispecchia il fisiologico cambio di posizione di persone non compromesse neurologicamente. Ciclo che all’incirca si avvicina agli 11 minuti. L’alternanza delle celle di solito avviene secondo cicli completi di 10 minuti con gonfiaggio e sgonfiaggio alternato ogni 5 minuti. In questo modo viene garantito lo scarico o la riduzione delle pressioni di interfaccia.
Le superfici sono anche differenziate per fasce di rischio, quindi Basso, Medio, Alto e Altissimo rischio, così come individuato dalla già citata scala di Braden.
Le caratteristiche che le differenziano sono:
• Altezza delle celle da 12 a 21 cm.
• Forma delle celle cella unica o doppia (ad Otto)
• Numero di celle da 15 a 20
• Grandezza delle celle in cm.
• Differente portata in Kg.
• Differenziazione delle pressioni nelle varie porzioni del materasso.
Differente distribuzione delle pressioni d’aria tra celle di testa (sempre le prime 3), celle che sostengono il tronco, celle che sostengono le gambe, zone differenziata o dedicata per i talloni.
I compressori e le parti meccaniche necessitano di manutenzione in quanto sono sottoposte ad usura, a meno che non siano governati da parti elettroniche che invece necessitano di taratura. Come tutte le macchine, effettuare la manutenzione ordinaria delle parti meccaniche ci garantisce la corretta insuflazione di aria ed il mantenimento degli standard di lavoro della superficie alle giuste pressioni. Queste superfici lavorano tutte al di sotto dei 32 mmHg che è il riferimento minimo della POC (Pressione di occlusione capillare).
L’avanzamento tecnologico di tali superfici è caratterizzato dalla possibilità di far lavorare il materasso a bassa pressione alternata o costante. Cioè ad una pressione che è sempre al di sotto dei 32 mmHg, in alcuni MAD la pressione di interfaccia è anche pari a 0 mmHg. Infatti all’interno dello stesso sono posizionati dei sensori in grado di rilevare il peso e la postura del paziente e di conseguenza in autonomia riprogrammano le pressioni nelle varie porzioni differenziate della superficie. Hanno compressori compatti, poco rumorosi ed anche dotati di funzione start and stop che permettono un notevole risparmio di energia elettrica.
Le superfici dinamiche a cessione d’aria sono composte da materiali sintetici con un elevato coefficiente di permeabilità, ciò consente ad una quantità di aria ben precisa di fuoriuscire dalla cover della superficie di supporto. L’aria ha la funzione di mantenere la cute del paziente asciutta contrastando gli effetti della sudorazione, dell’incontinenza e della produzione di essudato da ferite o lesioni già in atto. Purtroppo hanno compressori rumorosi e sempre in attività, infatti un’interruzione della corrente elettrica porterebbe all’immediato sgonfiaggio della superfice, a differenza delle superfici dinamiche che sono in grado di rimanere gonfie per diverse ore e che sfruttano tale principio per poter effettuare la “funzione Transfer”.
Alla luce di quanto sopra esposto nasce spontanea la riflessione su quanto disponibile in commercio e sullo spropositato uso di sovramaterassi a piccole celle presenti sul mercato e prescrivibili in base al nomenclatore ancora in uso. Le linee guida Epuap/Npuap sulla prevenzione delle Lesioni da Pressione, sconsigliano l’uso di tali superfici in quanto le celle di ridotte dimensione non riescono ad evitare l’effetto bottom out. In tali superfici l’alternanza delle celle si sviluppa in verticale, mentre le superfici a celle intere sviluppano un’alternanza di tipo orizzontale.
Quest’ultima favorisce ed agevola il flusso sanguigno. Il pericolo più tangibile è l’assenza di allarmi e l’assenza di prove elettriche certificate di cui invece sono dotate le superfici a bassa pressione o a cessione d’aria. Si tratta di allarmi di Bassa pressione (il paziente affonda troppo nella superficie) Alta pressione (pericolo di scoppio della superficie o indurimento eccessivo) e manutenzione compressore.
Concludo scrivendo che in commercio esistono diverse superfici che non rispecchiano i criteri di selezione descritti per la scelta dell’idonea superficie antidecubito ma che hanno prodotto negli anni numerosi studi a dimostrazione pratica della loro efficacia, mentre altre superfici che rispecchiano in pieno le caratteristiche di scelta, con tanto di letterature scientifica a supporto ma che creano comunque lesioni e pertanto dannose per la salute del paziente. Poiché ritengo che sia fondamentale la prevenzione primaria, sarebbe auspicabile che vengano rivalutati tali presidi nelle modalità più corrette in quanto il loro uso sostituisce l’intervento manuale dell’operatore sanitario nel riposizionamento del paziente per lo scarico delle pressioni. Inoltre va sempre considerato che una idonea superficie antidecubito evita l’uso di medicazioni in prevenzione o di ausili di scarico che hanno comunque scarsa efficacia o che agiscono solo localmente ma che incidono sui costi di gestione del paziente.
Articolo realizzato grazie alla preziosa collaborazione della
dottoressa Alessandra Vernacchia
Infermiere Legale e Forense specialista in Wound Care
Bibliografia:
(Nursing Research 1987, jul-ago; 36 (4) : 205-10)
Agenzia Regionale della Sanità Regione Friuli Venezia Giulia. (2006) Superfici antidecubito: caratteristiche e criteri di scelta per l’utilizzo e l’acquisizione. www.sanita.fvg.it/ars/specializza/progetti/allegati/LG%20superfici%20antidecubito.pdf
National Pressure Ulcer Advisory Panel (NPUAP). NPUAP support surface standards initiative: terms and definitions related to support surfaces (2007). (http://www.npuap.org/NPUAP_S3I_TD.pdf).
Per approfondimenti, si rimanda al dossier “Prevenzioni delle lesioni da decubito”, Quesiti Clinico-Assistenziali – anno 3, n.1, gennaio 2011.(http://fad.saepe.it/approfondimenti/NF11_lesioni_prevenzione_def.0.pdf)
Gefen A. How much time does it take to get a pressure ulcer? integrated evidence from human, animal, and in vitro studies. Ost Wound Manag 2008;54:30-5
European Pressure Ulcer Advisory Panel and National Pressure Ulcer Advisory Panel. Prevention and treatment of pressure ulcers: quick reference guide. Washington DC: National Pressure Ulcer Advisory Panel; 2009
www.salute.gov.it/imgs/C_17_pagineAree_1312_listaFile_itemName_1_file.pd
SNLG Regioni 3 – Ulcere da pressione: prevenzione e trattamento – Linee guida Regione Toscana
Superfici antidecubito: caratteristiche e criteri di scelta per l’utilizzo e l’acquisizione. AGENZIA REGIONALE DELLA SANITÀ – PROGRAMMA DI PREVENZIONE E TRATTAMENTO DELLE LESIONI DA DECUBITO. Febbraio 2006 e lesioni da pressione reg. Lombardia di O. Forma e A. Bellingeri;
Prevenzione e Trattamento delle lesioni da decubito –LINEE GUIDA INTEGRALI dell’ A.H.C.P.R.-versione italiana di A. Calosso e E. Zanetti;
Corso sulle L.d.D. 2001 Gruppo Geriatrico Genovese;
Le medicazioni avanzate di M. Romanelli
Bours G.J.J.W., De Laat E., Halfens R.J.G., Lubbers M., “Prevalence, risk factors and prevention of pressure ulcers in Dutch intensive care units”, Intensive Care Medicine, 27: 1599- 1605, 2001
Si parla di piede diabetico quando la funzione del piede è compromessa a causa di un danno alle arterie o ai nervi. E’ infatti una delle complicanze che si possono avere a causa di una iperglicemia o di altri fattori di rischio cardiovascolari come ad esempio il colesterolo, il fumo o la pressione arteriosa.
COMPLICANZE
 Un piede diabetico ha necessità di un costante controllo, di visite mediche, di una corretta igiene ed un corretto stile di vita poiché, se trascurato, può portare alla formazione di ulcere e piaghe.
Un piede diabetico ha necessità di un costante controllo, di visite mediche, di una corretta igiene ed un corretto stile di vita poiché, se trascurato, può portare alla formazione di ulcere e piaghe.
Questa patologia non è da sottovalutare poiché la formazione di un’ulcera da decubito può anche andare in necrosi e causare la necessaria amputazione dell’arto, o in cancrena, fino al provocare il decesso del paziente.
SINTOMI
I sintomi più comuni del piede diabetico possono essere:
il dolore, una infiammazione ed un rossore localizzati in un punto, formicolio o prurito alle gambe o ai piedi, la febbre in caso di infezione già in corso, difficoltà nel camminare, oppure una ridotta sensibilità dell’arto.
PREVENZIONE:
E’ Importante, prima che si formi l’infezione o la lesione da decubito, rivolgersi ad un diabetologo, monitorare lo stato del piede e prevenire l’insorgere di questa complicanza anche attraverso l’uso di dispositivi specifici adeguati.
BAVA DI LUMACA: QUALI SONO I BENEFICI?
Le lumache, o chiocciole, sono animaletti da tutti conosciuti; esse si spostano su qualsiasi tipologia di superficie, rischiando grandi escoriazioni, ma rimangono costantemente lisce. Come fanno?
La lumaca secerne ed espelle una particolare sostanza, comunemente nota come “bava di lumaca“, per proteggere il proprio corpo e per sigillare il guscio affinché batteri o altri animali non entrino al suo interno.
I COMPONENTI
La bava di lumaca è una sostanza ricca di molte sostanze benefiche tra cui elastina, collagene e vitamine A, C ed E.
Il collagene ad esempio agisce come ammorbidente, idratante ed elasticizzante (come anche l’elastina);
così facendo combatte l’insorgere delle rughe e rende la pelle più liscia; le vitamine A, C ed E, invece, aiutano l’ossigenazione della stessa con effetti antiossidanti e cicatrizzanti.
Accanto alle già citate sostanze, la bava di lumaca contiene l’acido glicolico, noto per il suo diffuso utilizzo nel trattamento di peeling e per la cura delle cicatrici, poiché favorisce la rimozione delle cellule morte presenti sulla superficie della cute, attraverso una leggera esfoliazione.
Tale trattamento è fortemente consigliato sia per il derma di soggetti anziani o chi presenta macchie, sia per pelli acneiche e grasse.
GLI EFFETTI
Proprio grazie alle proprietà dei suoi componenti, veniva considerata già dagli antichi un rimedio naturale di bellezza, e tuttora viene utilizzata per attenuare le macchie presenti sul viso o sul corpo ma anche le cicatrici, le scottature, le smagliature ed altri anestesismi cutanei.
Le sue ricche proprietà benefiche aiutano anche a ridurre gli arrossamenti della cute, l’acne, le irritazioni post depilazione e a combattere l’invecchiamento cutaneo.
Il collagene, l’elastina e le vitamine presenti nella bava di lumaca hanno quindi proprietà tonificanti, nutritive, antiossidanti ed idratanti per la pelle, e, rendendola più elastica, hanno anche effetti benefici nella riduzione e prevenzione delle rughe.
QUANDO E DOVE UTILIZZARLA
Le creme a base di bava di lumaca possono essere utilizzate sia sul volto che sul corpo, ed essendo completamente naturali, leggere e di facile assorbimento, possono essere utilizzate su qualsiasi tipologia di pelle e possono essere applicate tutti i giorni.
Sono particolarmente indicate per pelli acneiche e molto giovani, e per pelli più mature per limitare l’insorgere delle rughe.
Sono adatte per essere applicate giornalmente anche come base trucco e prima di andare a letto.
Per Ulcera da pressione (UdP) o lesione/danno da pressione, s’intende una lesione localizzata alla cute e/o al tessuto sottostante, solitamente localizzata su una prominenza ossea, come conseguenza diretta di una elevata/prolungata compressione o di forze di taglio o stiramento, che determinano uno stress meccanicoai tessuti e la strozzatura dei vasi sanguigni (EPUAP/NPUAP, 2014).
La causa dell’insorgenza delle UdP è naturalmente correlata alla pressione esercitata sulla cute e sui tessuti sottocutanei, ma diversi sono i fattori predisponenti o indirettamente responsabili.
Per maggiore chiarezza si usa distinguerli in fattori estrinseci o intrinseci:
Le UdP possono insorgere sia quando le aree corporee entrano in contatto con superfici di appoggio che esercitano alti livelli di pressione di breve durata, sia con bassi livelli di pressione di lunga durata.
Una revisione della letteratura indica che le UdP si sviluppano tra la prima ora e le 4-6 ore successive ad un carico continuato.
Quali sono i pazienti a rischio?
Quali sono le sedi maggiormente esposte al rischio?
Le Lesioni da Pressione, note come LdP, possono svilupparsi potenzialmente in tutti i punti di contatto tra corpo ed il piano di appoggio.
L’immobilità, in aggiunta, costituisce un fattore maggiormente predisponente l’insorgenza.
Negli adulti i siti più comuni sono il sacro e il tallone; nei bambini e neonati l’area maggiormente esposta è rappresentata dalla cute che ricopre l’osso occipitale.
Altre sedi predisposte al rischio di insorgenza di UdP sono:
Una menzione a parte meritano i dispositivi medici come ad esempio sondini naso-gastrici, tubi per tracheostomia, stecche per immobilizzazione, ecc., che accrescono la probabilità di causare lesioni da pressione sui tessuti molli, irritazione o, persino, il diretto danneggiamento della cute.
Come si attua la prevenzione?
Le raccomandazioni (NICE 2014 e WUWHS 2016) per la prevenzione delle UdP comprendono metodi per:
La valutazione del rischio deve essere eseguita al momento dell’accettazione del paziente (e comunque entro le 8 ore) avvalendosi di scale di valutazione appropriate (Linee guida AHQR, 2013):
I capisaldi della prevenzione sono pertanto costituiti da:
La frequenza del riposizionamento sarà determinata da (NPUAP/EPUAP 2009):
Allo scopo di prevenire le LdP, NON devono essere mai utilizzati:
E’ opportuno, inoltre, evitare:
Prevenzione lesioni da pressione: le raccomandazioni …
Il cambio di postura è l’insieme degli atti sostitutivi il cambio delle posizioni spontanee del paziente miranti al mantenimento dello schema posturale fisiologico.
Il movimento è considerato la prima difesa dell’organismo contro i danni da compressione: permette di alternare le zone sottoposte a compressione ed evitare ostruzione del microcircolo, con conseguente ischemia e necrosi dei tessuti. Le linee guida dell’AHCPR consigliano la rotazione periodica delle posture almeno ogni 2 – 4 ore nei soggetti non autosufficienti;
N.B. La movimentazione del paziente deve avvenire per rotazione o sollevamento, MAI per trascinamento.
Le posture che si possono far assumere al paziente sono:
Si considerano superfici idonee alla prevenzione delle lesioni, quei dispositivi specializzati per la ridistribuzione delle pressioni, con un microclima adeguato e/o funzioni terapeutiche, necessari non solo durante la fase di appoggio, ma anche nella fase di movimentazione del paziente.
Si possono classificare in:
Le caratteristiche di cui tener conto nella scelta di un presidio sono (EPUAP/NPUAP, 2014):
La scelta del dispositivo si basa su (Calosso, 2004):
Per quanto riguarda il paziente, la superficie antidecubito deve garantire:
Per evitare che le superfici risultino inefficaci dal punto di vista preventivo e/o terapeutico, è necessario:
Il sistema più semplice per poter valutare questo principio di sprofondamento nel materasso è quello di posizionare una mano aperta e tesa – con palmo rivolto verso l’alto – al di sotto del sistema antidecubito, in corrispondenza della lesione o della zona ove vi sia il rischio di lesione; se il caregiver sente almeno uno spessore di 2-3 cm tra la superficie del letto e la prominenza ossea, allora il supporto si può considerare adeguato per il paziente (Linee guida dell’AHRQ, 2006, Bellingieri A, 2013).
Conclusioni
La prevenzione delle LdP deve essere considerata una priorità assistenziale del personale addetto all’assistenza, che necessita dell’implementazione di strategie proattive e di protocolli standard. La carenza di misure inadeguate o insufficienti rappresenta un indicatore di scarsa qualità assistenziale ed è motivo di controversie legali.
I presidi utilizzati per la prevenzione delle LdP rappresentano misure aggiuntive in associazione ai protocolli standard di prevenzione, che hanno come principi cardine l’insieme di misure denominate SSKIN:
A cura di: Roberta Seri.
BIBLIOGRAFIA